単元「化学反応と熱」では,熱化学方程式,生成熱の計算,ヘスの法則,結合エネルギーなど理論的で計算をともなう項目が多く,生徒が理解しにくい分野の一つである。また,実験では,中和熱などを利用したヘスの法則の検証実験が多く取り入れられているが,化学反応に伴う熱の発生や吸収を実験を通して認識させる例は少ない。さらに,平成6年度から導入されている学習指導要領の内容に,「反応において発生又は吸収する熱量と物質量との関係を扱い,溶解熱にも触れること。」と述べられている。
一方,身近な市販品の中には,硝酸アンモニウムや酸化カルシウムの溶解熱を利用した瞬間冷却剤や保温剤があるが,生徒は「溶解熱」との関連性を知らないまま利用している場合が多い。
本研究では,この溶解熱に焦点を当て,特に瞬間冷却剤に使用されている硝酸アンモニウムの吸熱反応を通して,生徒の発想を引き出す指導の工夫を試みる。そこで,全員で水と溶質の質量を同じにした実験を行うことにより,各班で選択した実験の吸熱量を予想しやすくし,さらに各班の予想値を全体に提示し,他班の情報を知ることで生徒の発想を引き出しやすくする。また,各班の実験結果を一つのグラフに表すことで,吸熱量と溶質の質量との関係について自ら気付き,法則性を見つけ出せるようにすることをねらいとする。
| ア | 予想を立てやすくする工夫 溶解熱を測定するために,各班とも水と溶質の質量を同一にした共通の実験を行い,正確な実験操作を習得した後に,さらに共通の実験の結果をもとにすることで,水や溶質の質量を変えたときの結果を予想し,推論しやすくする。 |
| イ | 情報交換の場の工夫 黒板上に貼った「実験情報表」に,各班の共通の実験の結果や予想値などを記入させ,またそれをテレビモニターに映し出し,他班に情報を伝えやすくした。「実験情報表」によって,自分たちの考えが正しいかどうかを確信したり,逆に修正をすることができるようにする。 |
| ウ | 個別実験の工夫 溶質の質量を変えた場合,水の質量を変えた場合,水と溶質の質量の両方を変えた場合の3種類から各班一つを選択し,独自の実験として取り組めるようにする。ここでは,各班の選択が偏らないように生徒自身で調整する。 |
| エ | 法則性を見つけだす工夫 各班の個別実験の結果を,共通のグラフ用紙上に表すことで,クラス全員で一つのグラフを作成し,班単位の結果からは見えない法則性を発見させるようにする。この結果は,吸熱量と溶質の質量との関係を生徒自身が気付くための大きな手だてとなる。そしてこの気付きは,生徒自身にとって新しい価値あるものであると考える。 |
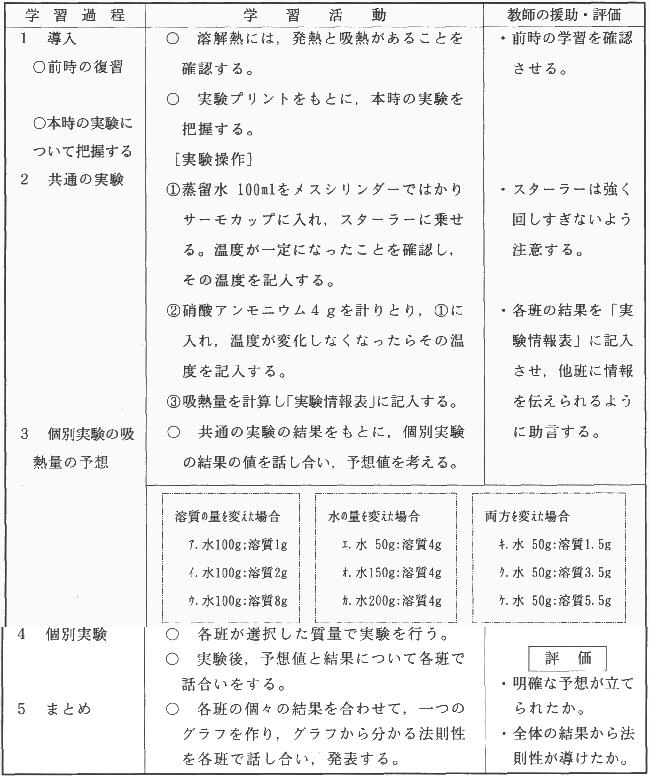
| ア | 単元 化学反応と熱 | ||||||||||||
| イ | 指導計画(9時間扱い)
|
||||||||||||
| ウ | 本時の指導
|
| ア | 授業後のアンケートから 表1 授業後のアンケート結果(平成9年11月4日実施 県立A高等学校1年5組40人)
※ aは「はい」,bは「どちらともいえない」,cは「いいえ」を示す。
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
| イ | 「実験情報表」から 表2 実験情報表 (共通の実験は水100gに溶質4gを溶解した。)
※データは,生徒が実験情報表に記入したものをそのまま記載した。 共通の実験の結果では全部の班とも類似した結果が得られている。硝酸アンモニウム4gを水に溶解させたときの吸熱量は,文献値から計算すると-1.29kJであり,実験操作や結果の処理を確実に行っていることが分かる 個別実験では,水の質量を一定にして溶質の質量だけを変えた班では,全ての班の予想と結果が一致している。これは,水の質量が一定であるため,吸熱量が溶質の質量に比例するという論理的な思考がしやすかったためと思われる。 一方,溶質の質量を一定にして水の質量だけを変える場合,「①吸熱量に水の質量の変化がどう影響するのだろうか。」,「②溶質の質量の水の質量に対する割合が変化することによって,温度変化はどうなるのだろうか。」という2通りの思考が必要である。「(エ)水50g:溶質4.0g」を選択した班が,これらを踏まえて予想を立てており,自分の発想をもとに話合い活動の中で認め合いながら,思考を深めて実験に取り組んだ様子が見られた。(資料1参照)
資料1 生徒の実験プリントの一部

|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ウ | 生徒の実験報告書から
資料2 生徒の実験報告書の中の感想文
資料2は,実験報告書中の感想文の一例である。この中には,「・・・気がつき始めた。」,「・・・自分の予想を加えておいて,・・・」などの記述があり,生徒自身の試行錯誤の様子や気付き・修正を加えていった過程が読み取れる。
|
今回,「観察・実験に創造的に取り組む理科学習の指導のあり方」について研究を進めてきたが,次のようなことが分かった。
| ア | 生徒の発想を引き出す工夫として,最初に共通の実験を行ったが,生徒は共通の実験の結果を活用することで,試行錯誤しながら論理的に思考を行い,容易に個別実験の予想を立てることができる。 |
| イ | 「実験情報表」の活用により,他の班の予想と比較を行い,自分の予想が正しいのかどうかを確信したり,逆に修正を加えたりして,創意工夫をしながら実験を進めることができる。 |
| ウ | 各班の個別実験の結果を一つのグラフにすることにより,自分の結果だけでは得られない法則性に気付かせることができ,生徒自身にとって新しい価値ある法則性を発見できる。 |
| ア | 個別実験で,水と溶質の両方の質量を変えた場合の予想値を考えるのが難しかった。もっと簡単な質量にするなど,より予想をたてやすくできるよう工夫をしていきたい。 |
| イ | 生徒が吸熱量を予想する時,「実験情報表」に,温度変化を予想させる欄を設けるなどさらに生徒の発想が引き出しやすくなるような授業展開を工夫していきたい。 |